Московский государственный
университет имени М.В. Ломоносова
Физический факультет
Курсовая работа
“Свёртывание крови и гемостаз”
Работа подготовлена
Студентом 2-го курса
Из 208-ой группы
Гулькиным Дмитрием Николаевичем
Работа подготовлена для кафедры
Биофизики
Научный руководитель: Пантелеев
Михаил Александрович
Оглавление.
1)
Введение
2)
Рост тромба в условиях гемостаза
3)
Биохимия свёртывания крови
А) Тромбин
Б)
Каскадное устройство системы свёртывания крови
В) Путь
протеина С
Г)
Свойство тромбина
Д)
Фибринолиз
4) Заключение
5) Используемая литература
Введение.

«Выживает сильнейший» или «сильные разделываются со слабыми, умные
разделываются с сильными».
Эти и другие законы Джунглей
описал в своих произведениях английский писатель Джозеф Киплинг, нобелевский
лауреат по литературе.
Описывая джунгли, он наглядно показывает некий свод правил, который распространяется на все живое, окружающее нас. И мы тоже подчиняемся этим правилам, так как это неотъемлемая составляющая нашего мира и нашей сущности. Можно с разных точек зрения описывать этот свод правил и можно придумывать ему разные названия, но наиболее точно сформулировал его Чарльз Дарвин - естественный отбор. Лаконично и точно.
В чем отбор заключается? На этот сложный вопрос невозможно дать краткий ответ. Поскольку данный вопрос не является темой сего обзора, то ограничимся краткими выводами, основанными на итогах естественного отбора.
Выживают высокоорганизованные, приспособленные к окружающему миру и его изменениям особи, которые волей отбора не являются маленькими, а напротив, гораздо более крупными, нежели первые организмы. Хотя стоит отметить, что сверхкрупные относительно человека животные давно вымерли: остались лишь немногочисленные морские животные. Но как управлять системой и множеством отдельно работающих механизмов, коими являются все организмы, все конечности организмов?
Из любого устройства механизма, любой фабрики можно почерпнуть, что необходимы две составляющие: единый центр управления (головной мозг и нервная система) и подача энергии, материалов, но также важно своевременное устранение переработанного. Эту роль, роль конвейера, транспортной системы играет кровь - внутренняя жидкая среда, которая способна растворять необходимые вещества и быстро доносить их до каждой клетки организма. Но у жидкой среды есть свойство: она в одинаковой степени может переносить как полезные, так и вредные для организма ресурсы, а также под действием внутреннего давления будет вытекать, если нарушена ее оболочка. Это порождает два тесно связанных свойства организма: иммунитет и гемостаз (от греческого haimatos – кровь, stasis-остановка), отвечающих двум проблемам: продление регуляции и своевременное устранение «вражеских» тел из организма и проблеме быстрой и надежной остановки кровотечения.
Так уж сложилась эволюция, или же отбор, что организмы, решившие только одну из двух проблем, проиграли гонку за выживание. Поскольку одна проблема неизменно влечет вторую, вне зависимости от того, как с ней бороться. Так ранее беспозвоночные (по предположению организм с открытой системой кровообращения – системы, где кровь мало отличается от окружающей организм среды) не боялись тромбозов и по тому не нуждались в сложной системе ингибирования гемостаза. «Пробоины» просто затыкались гемоцитами. И это скорее была иммунная защита, нежели гемостатическая. И по указанной выше причине, эти организмы проиграли отбор.
Очевидно, что сама структура кровеносной системы усложнялась под натиском увеличения размеров организма, что приводило к новым путям совершенствования системы гемостаза. Но в чем она заключается?
Для начала - увеличение кровеносной системы влечет обязательно к увеличению самого числа каналов и сосудов. Поскольку это все единая система, то закупорка нескольких сосудов может привести к смерти организма: это и дает возникновение сложной системы регуляции процессов гемостаза. Так одним из этих путей стала возникшая плазменная система свертывания – разветвленный каскад биохимических реакций, результатом работы которого является полимеризация белка фибрина и появление идеальной заплатки для раны, вследствие желирования плазмы крови.
А, что собственно, представляют эти пути? Можно долго фантазировать на эту тему, но эволюция оставила нам всего три пути. И так, вопрос сводится к тому, что делать с поврежденным сосудом? Для начала можно его напрочь перекрыть или частично, путем сокращения мышц оболочки сосуда под действием активаторов – серотонина и тромбоксана А-2,секретируемых активированными тромбоцитами. Этот путь рискован, так как, если сосуд является ключевым или просто важным в системе кровообращения, то может привести к смерти.
Также можно «заделать пробоину» путем тромбоцитарного гемостаза. В крови присутствуют специализированные клетки крови, тромбоциты, способные к активации. Будучи активированными, они приклеиваются к поврежденным тканям и друг к другу, формируя агрегаты, перекрывающие путь к потери крови. Плазма крови может просачиваться через этот тромб, но клетки крови пройти уже не могут. К тому же, щели между тромбоцитами быстро заполняются фибриновым гелем.
Ну, и третий путь связан с превращением жидкости в гель. На основе этого физического смысла лежит плазменная система свертывания. Этот гель – особая форма коллоидной системы, в которой пористая сеть пронизывает жидкость на микроскопическом уровне. Трехмерная сеть, создаваемая полимеризующимися молекулами белка фибрина, способна удерживать в своих ячейках жидкость, многократно превосходящую ее по массе.
И все эти три способа объединяются в категории: первичный (сосудисто-тромбоцитарный) и вторичный (плазменный). Первичный гемостаз реагирует на повреждение довольно быстро (1-3 минут), а плазменная система свертывания (характерное время около 10 минут) делает сгусток прочным и предотвращает возобновление кровотечения. Но зачем организму столько способов гемостаза? Жизненные реалии таковы, что повреждения могут носить разный характер и разную степень тяжести в разных по толщине и важности сосудах. И ни один из перечисленных способов гемостаза не может эффективно решать все эти проблемы. Только комплекс и слаженная работа этих способов может решить проблему гемостаза.
В
данном обзоре будут освещены основные принципы одного видоа гемостаза:
плазменный, поскольку сосудистый способ прост и сводится к сокращению мышц,а
тромбоцитарный будет частично описан через рост тромба при плазменном гемостазе.
Рост тромба в условиях кровотока.
Один из видов первичного механизма гемостаза является плазменный способ. Что он из себя представляет?
Для начала – это сложная система каскадов биохимических реакций активации системы свертывания, которая относительно давно и достаточно изучена. Но не стоит забывать, что сама суть этого способа гемостаза неразрывно связана с геометрическими и пространственными изменениями внутри сосудов,рост тромбов происходит при непосредственном взаимодействии с потоком крови, что неотъемлемо связано с ламинарным или турбулентным течением крови и диффузии основных активаторов и ингибиторов свертывания. Изучение соответствующих реакционно-диффузных моделей позволило теоретически проанализировать условия и механизмы формирования in Vitro (лат. «в стекле» -это технология выполнения экспериментов, когда опыты проводятся в пробирке, либо в более общем смысле, вне живого организма) фибриновых структур- тромбов в одномерных и двухмерных системах.
Наиболее распространена классическая
модель французского врача Пуазеля о
течении крови в сосуде цилиндрической формы ( работа является классической
также и в аэрогидродинамике).

Конечно, в общем случае
свойства крови (вязкость, плотность) не постоянны и зависят от множества
факторов, но Пуазель рассматривал идеальную жидкость. Также «идеальным»
недеформирующимся рассматривается сам тромб, хоти в реальности это не так.
Рассмотрим эту модель (рис.0). Течение крови описывается стационарным (усредненным по времени) уравнениями динамики вязкой несжимаемой жидкости. Тогда область локального повреждения будет выступать в качестве места активизации каскада биохимических реакций системы свертывания крови, а размер области и интенсивность активации в качестве параметров задачи.
Тогда, на основе всего выше
сказанного, течение вязкой жидкости описывается стационарными уравнениями
Навье-Стокса:
![]()
![]() где V – скорость движения жидкости,
где V – скорость движения жидкости, ![]() - кинематическая вязкость,
- кинематическая вязкость, ![]() – плотность. Образование, распад и
распространение по пространству ключевых метаболитов (промежуточные продукты обмена веществ в живых клетках) описывается
уравнением вида
– плотность. Образование, распад и
распространение по пространству ключевых метаболитов (промежуточные продукты обмена веществ в живых клетках) описывается
уравнением вида
![]() +
+![]()
где ![]() – коэффициент диффузии k -го метаболита,
– коэффициент диффузии k -го метаболита, 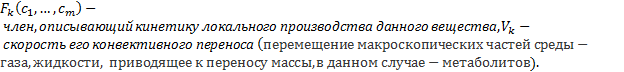 Далее будем
полагаться, что скорость переноса каждого из основных метаболитов даётся
выражением
Далее будем
полагаться, что скорость переноса каждого из основных метаболитов даётся
выражением
![]()
Для фибрина-полимера ![]() и
и ![]() полагаются равным нулю, а для всех растворимых
метаболитов
полагаются равным нулю, а для всех растворимых
метаболитов ![]() - единице.
- единице.
Граничные условия для уравнений
Навье-Стокса принимаются следующими: на сосудистых плёнках и поверхности тромба
брались условия прилипания ![]() , где
, где ![]() - тангенсальная и
нормальная к границе расчётной области составляющие скорости соответственно. На
левой и правой границах рассматриваемой области сосудистого русла задавались
значения давлений. Величина перепада давления считалась постоянной, что подразумевает
наличие коллатериального кровотока (обходной
кровоток кровеносных сосудов у позвоночных животных и человека, обеспечивающий
приток или отток крови в обход основного сосуда). Как правило, мелкие и
средние сосуды объединены в достаточно развитые сети, в которых каждый
отдельный сосуд оказывается эффиктивно шунтированным, т.е удолетворяется
условие, когда создан обходной путь для поступления крови из основного сосуда
(аорты) в систему коронарных сосудов, минуя суженный (стенозированный) участок.
На входе сосуда полагалось
- тангенсальная и
нормальная к границе расчётной области составляющие скорости соответственно. На
левой и правой границах рассматриваемой области сосудистого русла задавались
значения давлений. Величина перепада давления считалась постоянной, что подразумевает
наличие коллатериального кровотока (обходной
кровоток кровеносных сосудов у позвоночных животных и человека, обеспечивающий
приток или отток крови в обход основного сосуда). Как правило, мелкие и
средние сосуды объединены в достаточно развитые сети, в которых каждый
отдельный сосуд оказывается эффиктивно шунтированным, т.е удолетворяется
условие, когда создан обходной путь для поступления крови из основного сосуда
(аорты) в систему коронарных сосудов, минуя суженный (стенозированный) участок.
На входе сосуда полагалось ![]() , на выходе граничные условия
считались свободными.
, на выходе граничные условия
считались свободными.
Так как даже после сделанных
упрощений задача остаётся достаточно сложной для численного исследования, далее
будет рассмотрена двумерная постановка задачи. Сосуд заменяется отрезком
плоского канала с теми же гидродинамическими характеристиками. Отметим, что
такая замена возможно лишь в силу использования стационарных уравнений
Навье-Стокса. При рассмотрении нестационарных уравнений, описывающих развитие
тромба в приближении плоского канала, возможна потеря устойчивости ламинарного
течения в области умеренных значений числа Рейнольдса (Re ~ 1).
Но даже полное или, как в данном случае, частичное математическое описание не дает ясной картины явления, ведь в разных по толщине сосудах давления и скорости течения разные (хотя это и описывается Пуазелем в другой задаче). Так важным свойством среды является скорость течения и ее пороговое значение.
Приведённый на рис.1 сценарий
развития соответствует относительно невысоким скоростям кровотока. В этом
случае первичная волна активации свёртывания, в конечном счёте, гасится волной
ингибитора, вследствие этого рост тромба останавливается. Иными словами, имеет
место локализованное тромбообразование в окрестности места повреждения
сосудистой стенки.
Представленные на рис.1
результаты подсчётов показывают, что пороговая активация системы свёртывания в
пристеночной области размером ![]() , в которой амплитуда
, в которой амплитуда ![]() возмущения стационарного состояния по
активатору по начальный момент полагалась равной 10 нМ, сопровождается ростом
полимерного сгустка. Формирование последнего сопровождается вытеснением
кровотока из области, прилегающей к месту повреждения. Сформировавшийся в
конечном счёте тромб перекрывает по одной трети поперечного размера сосуда
возмущения стационарного состояния по
активатору по начальный момент полагалась равной 10 нМ, сопровождается ростом
полимерного сгустка. Формирование последнего сопровождается вытеснением
кровотока из области, прилегающей к месту повреждения. Сформировавшийся в
конечном счёте тромб перекрывает по одной трети поперечного размера сосуда ![]()
 При заданном перепаде давления
При заданном перепаде давления ![]() P=5 г
P=5 г ![]() максимальная скорость на входе
представленного на рис. Участке сосуда составляла V = 2*
максимальная скорость на входе
представленного на рис. Участке сосуда составляла V = 2*![]() . Соответствующие числа
Рейнолдьса Re=
. Соответствующие числа
Рейнолдьса Re=![]() и Пекле Pe=
и Пекле Pe=![]() были равны 0.5*
были равны 0.5*![]() и 10 соответственно.
и 10 соответственно.
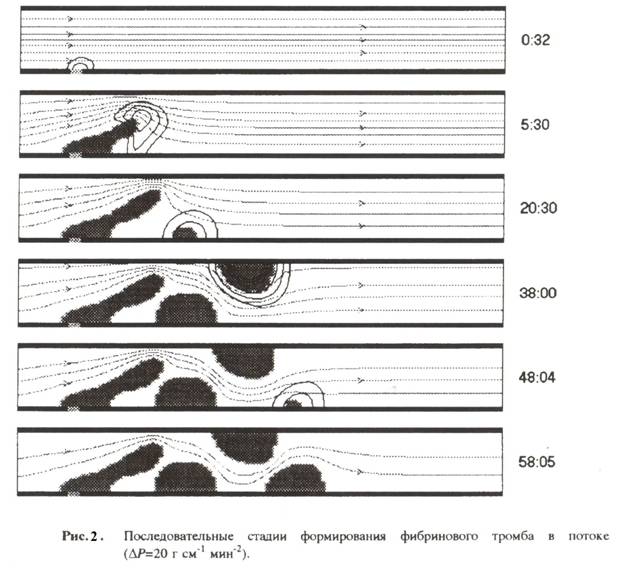 Иначе развиваются события, если скорость
кровотока превышает определённое пороговое значение. На рис.2 типичный сценарий
последовательного формирования пеночки
тромбов вниз по потоку от области первичной инициации свёртывания.
Картина тромбообразования сильно отличается от представленной на рис.1.
Физической причиной столь драматических изменений сценарий тромбообразований
является неспособность волны противосвёртывания (т.е. волны ингибитора – сама
суть которого будет рассмотрена позже) остановить (ослабить до подпорогового уровня) волну свёртывания в условиях более
интенсивного кровотока и, следовательно, больших скоростей сдвига.
Представленные на рис.2 результаты получены при тех же значениях парметров, что
и на рис.1, только величина перепада давления
Иначе развиваются события, если скорость
кровотока превышает определённое пороговое значение. На рис.2 типичный сценарий
последовательного формирования пеночки
тромбов вниз по потоку от области первичной инициации свёртывания.
Картина тромбообразования сильно отличается от представленной на рис.1.
Физической причиной столь драматических изменений сценарий тромбообразований
является неспособность волны противосвёртывания (т.е. волны ингибитора – сама
суть которого будет рассмотрена позже) остановить (ослабить до подпорогового уровня) волну свёртывания в условиях более
интенсивного кровотока и, следовательно, больших скоростей сдвига.
Представленные на рис.2 результаты получены при тех же значениях парметров, что
и на рис.1, только величина перепада давления ![]() P полагалась в 4 раза большей. Безразмерные
параметры в этом случае имеют значения Re = 2.0*
P полагалась в 4 раза большей. Безразмерные
параметры в этом случае имеют значения Re = 2.0*![]() Pe = 40, Gu = 2.4.
Pe = 40, Gu = 2.4.
Таким образом, увеличение интенсивности кровотока способно приводить к
качественной смене характера тромбообразования. Локализованное
тромбообразование (рис.1) сменяется множественным (рис.2). Существенно то, что
вторичные тромбы возникают в сосудистом русле вдали от места первичного
повреждения сосудистой стенки, в окрестности которой собственно и иееет место
первичная активация системы свёртывания.
Формировние каждого очередного вторичного сгустка дополнительно повышает
сопротивление рассматриваемого участка сосуда – R, вследствие чего снижается интенсивность полного кровотока в сосуде – Q: ![]()
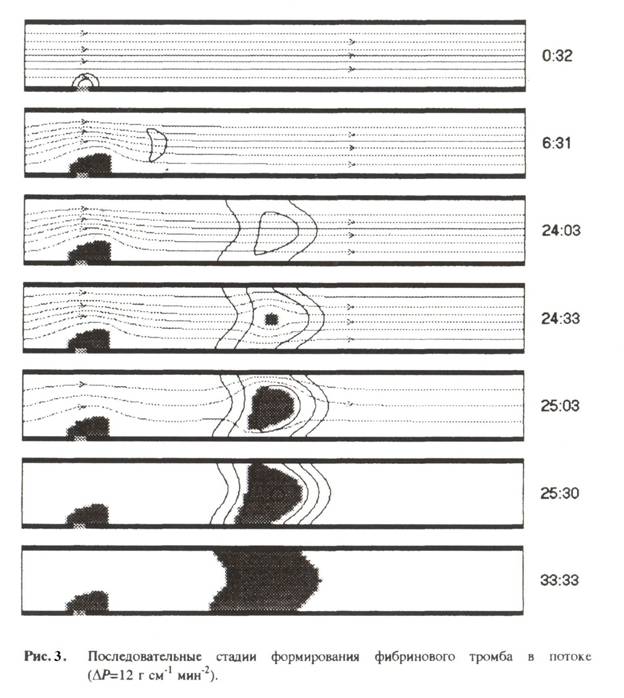 На рис. 3 представлен
характерный сценарий развития тромбообразования, при котором рост вторичного
тромба полностью останавливает кровоток в сосуде. Закупорка сосуда тромбом
является результатом взаимодействия гидродинамического течения с системой
свёртывания. Расчёт при тех же значениях параметров, что и на рис. 1, лишь
величина перепада
На рис. 3 представлен
характерный сценарий развития тромбообразования, при котором рост вторичного
тромба полностью останавливает кровоток в сосуде. Закупорка сосуда тромбом
является результатом взаимодействия гидродинамического течения с системой
свёртывания. Расчёт при тех же значениях параметров, что и на рис. 1, лишь
величина перепада ![]() P полагалась в 2,4 раза большей. Для соответсвующих
безразмерных параметров имеем: Re = 1.2*
P полагалась в 2,4 раза большей. Для соответсвующих
безразмерных параметров имеем: Re = 1.2*![]() Pe = 21, Gu = 1.4. Сравнение рис. 3 и рис. 2 показывает,что при меньшей интенсивности
кровотока процесс формирования вторичного тромба занимает большее время. Конечная масса образующегося тромба
тоже оказывается заметно выше.
Pe = 21, Gu = 1.4. Сравнение рис. 3 и рис. 2 показывает,что при меньшей интенсивности
кровотока процесс формирования вторичного тромба занимает большее время. Конечная масса образующегося тромба
тоже оказывается заметно выше.

На рис. 4 показана динамика
тромбообразования интересная с точки зрения, что структура образующегося в
конечном итоге тромба является “пористой”. Внутри полимерного сгустка остаются
области с несвернувшейся жидкостью.
Биохимия свёртывания крови
Теперь разберём плазменный
гемостаз с точки зрения каскада реакций. Также, как и
другие способы, плазменный гемостаз сводится к остановке кровотечения. Однако
достигается это путём полимеризации белка фибрина, который путём каскадов
активации превращается в “желе”, “ затыкая ”вреждение сосуда. Т.е. основной реакцией (в том числе и единственной)
в этом способе является превращение фибриногена в фибрин и последующую
полимеризацию белка фибрина. 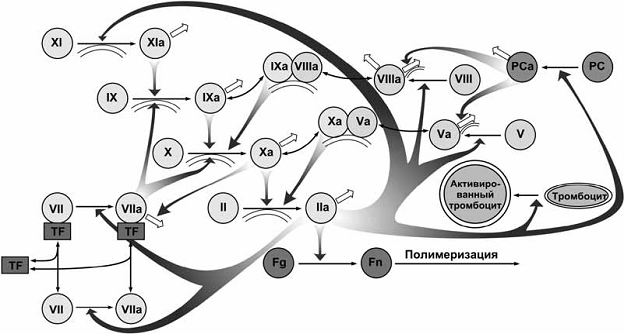 Рис. 1 Основные реакции
плазменной системы свертывания крови. Реакции активации факторов свертывания
показаны односторонними тонкими черными стрелками. При
этом фигурные стрелки показывают под действием каких именно ферментов
происходит эта активация. Обратимые реакции формирования
комплексов показаны двусторонними тонкими черными стрелками. Ингибирование
показано короткими белыми стрелками. Чтобы избежать перегруженности, на схеме
не показаны: связывание тромбина с тромбомодулином, активация тромбоцитов
какими-либо активаторами кроме тромбина, секреция
тромбоцитов и контактная активация свертывания.
Рис. 1 Основные реакции
плазменной системы свертывания крови. Реакции активации факторов свертывания
показаны односторонними тонкими черными стрелками. При
этом фигурные стрелки показывают под действием каких именно ферментов
происходит эта активация. Обратимые реакции формирования
комплексов показаны двусторонними тонкими черными стрелками. Ингибирование
показано короткими белыми стрелками. Чтобы избежать перегруженности, на схеме
не показаны: связывание тромбина с тромбомодулином, активация тромбоцитов
какими-либо активаторами кроме тромбина, секреция
тромбоцитов и контактная активация свертывания.
Но это лишь основной её итог,
”верхушка айсберга”, ведь есть ещё огромный каскад факторов,имеющих
регуляторное значение. Его целью явлется обеспечить
превращение фибриногена в фибрин в нужном месте и в нужное время и ни в коем
случае не в другом месте.
Тромбин
Разберём более подробно суть белка тромбина. Тромбин - главный фермент системы свёртывания крови. Исследование кинетики тромбина может принести массу дополнительной информации, которая недоступна из простого наблюдения за процессом полимеризации фибрина.
Тромбин принадлежит к семейству
сериновых протеиназ - ферментов, способных осуществлятьпротеолиз - расщепление
пептидных связей в белках, т.е. по своим свойствам тромбин похож и близок к
пищеварительным ферментам(трипсин и химотрипсин),что и подтверждает наличие у
него функционально необходимой аминокислоты серина в активном сайте.
Но у всех сериновых протеиназ есть свойство: они могут запросто разрушать клетку, в которой они производятся. К примеру: желудок человека моментально бы “разъелся” изнутри, если пищеварительные ферменты работали постоянно. С этой целью, они синтезируются в форме зимогена (неактивный вид), где белок свёрнут так, что активный сайт его закрыт и недоступен для белков. Чтобы его активировать, необходимо расщеплять пептидную связь, удерживающую активный сайт в недоступном состоянии. По такой системе устроен весь каскад свёртывания крови: все белки (или факторы) не могут постоянно циркулировать в крови: иначе каскад мог бы “запускаться” непрерывно и превращал бы всю нашу кровь в “желе”. Это удобно с точки зрения повреждений-человек не обращал бы никакого внимания на травмы, связанные с её потерями (их просто бы не было). Но и отсутствие жидкой крови противоречит выводам, сделанным во введении этого обзора. Так, по написанному выше, неактивного тромбина - протромбин, или же фактор II, а у активного по общей нумерации – фактор IIа (в частности тромбин активируется активным фактором Xа – фактор Стюарта-Прауэра).
Каскадное устройство системы свёртывания крови.
Общую структуру образования
фибрина, тромбина и других белков можно организовать в общую структуру. Так, фибрин получается из фибриногена в результате частичного
протеолиза фибриногена тромбином. Тромбин же, в свою очередь, получается в
результате похожего процесса с участием фактора Xа. В принципе, эту
цепочку,называемую каскадом, можно продолжать долго, но нужно сделать
предположение у существовании “начальной точки” каскада, и тогда каскад можно считать процессом реальным , а не
бесконечным и зацикленным. Такой точкой является так называемый комплекс “внешней
теназы” (внешний путь свёртывания или тканевого фактора). Этот комплекс состоит из фактора VIIа –
проконвертин ( и его активной формы) и тканевого фактора TF. Особенностью фактора VIIа является
несовершенство его активного сайта, что снижает его ферменативную активность и
позволяет ему находиться в крови именно в активном состоянии (что из
вышесказанного именно и подразумевает наличие “отправной точки”). Основной
функцией фактора VIIа является активация вышеупомянутого фактора Xа. Но, чтобы
полную ферментативную активность, фактору VIIа необходим кофактор - тканевый фактор. Этот
трансмембранный белок присутствует в мембранах почти всех клеток организма, за
исключением эндотелия сосудов и клеток крови. Так он надёжно изолирован от
крови, однако малейшее повреждение сосудов приводит к его обнажению и контакту
с кровью. Связывание фактора VIIа с тканевым факторм приводит к изменению
конформации фактора VIIа и он приобретает способность расщеплять и
активировать фактора Xа.
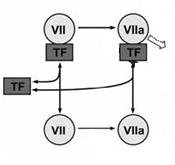
Рис. Комплекс “внешней теназы”
Остановимся подробнее на
кофакторах (и мембранных зависимостях). Фактор Xа сам по себе
очень плохо активирует прототромбин. Для того, чтобы эта реакция шла с высокой
скоростью. Ему необходимы кофакторы – фактор Vа и отрицательно
заряженная фосфолипидная поверхность. Фактор Vа представляет
собой белок – кофактор, получающийся из фактора V путём частичного расщепления под действием
тромбина. Получается замкнутая система: фактор Xа изначально
активирует небольшое количество протромбина в тромбин, который активирует
фактор V . Затем фактор Vа увеличивает скорость активации протромбина
фактором Xа, а продукт этой реакции, тромбин,
опять активирует фактор V. Это называется петлёй положительной обратной
связи: продукт реакции стимулирует своё собственное производство (Рис. 2).
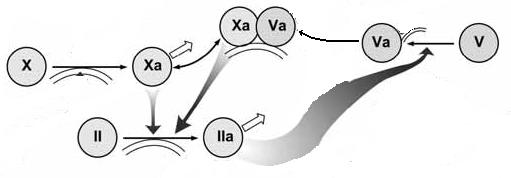
Рис 2. Петля
положительной обратной связи
Можно выделить и другу петлю
положительной обратной связи, связанную с активацией теперь самого фактора X. Помимо того,
что этот фактор активируется комплексом внешней теназы, он активируется
фактором IXа, который, в свою очередь, может активироваться внешней теназой. Однако,
эта реакция протекает крайне медленно. Она ускоряется благодаря формированию
комплекса факторов IXа и VIIIа на поверхности активированных тромбоцитов. Этот
комплекс, который, как и внешняя теназа, активирует фактор X, называется “внутренней
теназой”(Рис. 3).
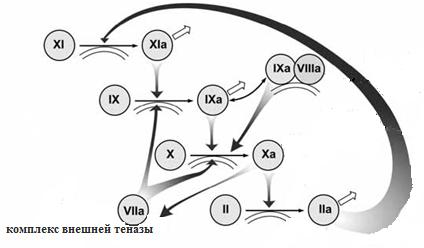
Рис. 3. Петля положительной обратной
связи – комплекс внутренней теназы
Итак, мы обсудили конечный этап
свёртывания крови (превращение белка фибриногена в фибрин), промежуточный
(активатор-белок X) и начальный (внешняя теназа). Но для чего нужны
тогда обратные связи и различные каскады?
В теоретической работе
М.А.Ханина показано, что добавление в каскад положительных обратных связей
может приводить к появлению в системе нескольких устойчивых состояний, между
которыми возможны переключения. Эта и другие последующие за ней работы привели
к важной концепции. Положительные обратные связи в сочетание с ингибиторами
факторов свёртывания способны формировать порог – свойство системы почти не
реагировать на малую активацию, но быстро срабатывать при появлении большой.
Иными словами, каскад реакций
сам по себе неустойчив, и для предотвращения неконтролируемой активации в крови
присутствуют ингибиторы сериновых протеиназ свёртывания (основными ингибиторами
свёртывания являются антитромбин III и ингибитор пути тканевого фактора или tissue factor pathway inhibitor – TFPI).
Стоит упомянуть ещё одну
положительной обратной связи - фактор IX может также
активироваться фактором XIа, который, в свою очередь, активируется
тромбином. Это самая длинная из петель положительной обратной связи в
свёртывании крови: она ведёт с самого низа каскада на самый его верх. Однако,
фактор IX итак прекрасно активируется внешней теназой, даже не прибегая к сравнению
в скорости активации. Долгие годы этот вопрос оставался открытым. И по сей день
неизвестен его смысл, но есть несколько предположений и вариантов.
Обнаружено, что положительные обратные
связи имеют большое значение именно для распространения свертывания.
Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток
вдали от активатора, т. к. фактор Xa быстро ингибируется в плазме и не может далеко отойти от
активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне
на это способен. А там, куда тяжело дойти и ему, начинает работать фактор XIa, активированный
тромбином. Таким образом, наличие петель положительных обратных связей помогает создать
трехмерную структуру сгустка, позволяя ему эффективно формироваться вдали от
активатора.
Путь
протеина С.
В самом начале этого обзора
задавался вопрос о возможности полного превращения жидкой крови в “желе”. Уже
обсужден вопрос о пороговой структуре каскадов. Однако, что происходит, если
процесс всё же запущен? Ведь ранее говорилось только о положительных цепях
(хоть и с различными скоростями протекания процесса). Для избегания подобной
ситуации необходим процесс, тормозящий каскад или же регулирующий размер
фибринового сгустка. Одним из предполагаемых механизмов такого рода является
путь протеина С – важнейшая отрицательная обратная связь в свёртывании.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин.
Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа
использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы
их инактивировать. Активированный протеин С производит несколько
протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их
полностью терять свою кофакторную активность. Таким образом, тромбин, продукт
каскада свертывания ингибирует свое собственное производство.
Однако и тут возникает
своеобразная “дупликация”. Пусть факторы Vа и VIIIа не являются периновыми протеиназами и не могут
быть ингибированы обычными ингибиторами плазмы, но фактор VIIIа, например, нестабилен и может ингибироваться сам
по себе путём диссоциации на субъединицы. Ответом на этот вопрос (или
частичным) стали пространственно неоднородные экспериментальные подходы. Было
показано, что добавление в пространственно неоднородную экспериментальную систему
тромбомодулина приводит к остановке растущего сгустка на некотором расстоянии
от активатора, зависящем от концентрации тромбомодулина.
Свойства
тромбина.
Рассмотрев многие из цепей
положительных обратных связей и цепь отрицательной связи, можно найти в них
общие элемент - тромбин. В принципе,
ничего удивительного здесь нет: ведь именно он, фактор II или же тромбин, является единственным активатором
фибриногена в фибрин. Т.е. получается, что тромбин имеет свойство быть
непостоянным по предназначению.
В отсутствие кофакторов тромбин
прокоагулянтен: он расщепляет фибриноген, факторы XI, V, VIII, активирует тромбоциты. Активация
протеина С идет очень медленно. Однако, при связывании тромбомодулина кинетика
реакций драматически изменяется — расщепление фибриногена и других факторов во
много раз замедляется, а протеина С — ускоряется на несколько порядков. Можно сказать, что тромбин
существует в двух формах —про- и антикоагулянтной.
Но как же происходит это самое “переключение”?
Подобное «переключение» лежит в основе
механизма запуска свертывания: фактор VIIa, «испорченный» фермент, включается
при связывании
тканевого фактора. Точно так же, факторы IXa и Xa, хоть и не полностью «испорченные», все же
способны на много порядков увеличивать свою эффективность при связывании кофакторов
факторов VIIIa и Va.
Можно заметить, что подобная
регуляция и “переключение” свойственно многим ферментам. Иными словами при всём
огромном количестве ферментов, практически нет ни одного, который бы нёс
исключительно узкую функцию. Природа позаботилась о взаимозаменяемости элементов
и дополняющей друг друга системе, при этом максимально нагрузив каждый фермент
различными функциями. Стоит отметить, что подобное свойство используется не
только в крови, но и во многих других системах в природе и организмах.
Фибринолиз.
Но если рассмотрена частична
система образования фибринового сгустка, то необходимо разобрать вопрос об его
удалении - система фибринолиза.
Фактически, фибринолиз —разрушение
фибринового сгустка по мере восстановления поврежденной ткани — часто
рассматривают как еще одно звено гемостаза, неразрывно связанное с сосудистым, тромбоцитарным и плазменным.
Основной белок системы фибринолиза, плазмин, выполняет собственно расщепление фибриновой сети.
Будучи сериновой протеиназой, родственной протеиназам свертывания, плазмин
формируется из неактивного предшественника плазминогена под действием одного из двух
активаторов плазминогена, тканевого или урокиназного. В норме эти реакции идут
очень медленно, но они многократно ускоряются под воздействием фибрина. Таким образом, конечный
этап функционирования системы свертывания является запускающим сигналом для системы фибринолиза.
Но эта система столь же сложна,
как и сама система свёртывания, поэтому описать её (хотя бы частично) было бы
затруднительно. Но необходимо отметить, что эта система
пересекается с системой свертывания еще как минимум в двух существенных местах. Во-первых, плазминоген может активироваться
факторами контактной активации.33 Во-вторых, тромбин способен активировать
белок, называемый тромбинактивируемый ингибитор фибринолиза. Этот белок затем начинает
модифицировать фибрин, делая ускорение реакций фибринолиза менее эффективным.
Заключение.
Подведём некоторые итоги этого
кратокого обзора по теме свёртывания крови и гемостаза.
Для начала приведены основные
положения всего плазменного гемостаза с точки зрения тромбообразования – некой
математической модели, приближённо схожей с классическими постулатами о
ламинарном и турбулентном течениях Пуазеля. Также были приведены основные
сценарии развития тромбообразования в зависимости от параметров системы
(скорости течения, размеров капилляра, вязкости среды, а также числа
Рейнольдса), в том числе и приведены случаи полного перекрывания тромбом
капилляра, ведущий к плачевным событиям.
Также был дан краткий анализ
биохимии свёртывания крови. Приведены основные постулаты и свойства в каскадной
системе свёртывания. Также были выделены основные цепи обратных связей, как
положительных, так и отрицательных, выступающих как некие усилители сигнала или
наоборот тормозящие процесс соответственно.
Затронута была и тема свойств
факторов и тромбина в частности. Показана его сложная функциональная
принадлежность к системе свёртывания крови и проведена аналогия с другими
ферментами.
И в заключение хочется отметить,
что сам по себе вопрос свёртывания крови является до сих пор открытым. Ведь до
сих пор неизвестны значения множества реакций и каскадов свёртывания. Конечно,
направления в этой области ведутся и, стоит заметить, что эта область в
биофизике и в науке в целом является одной из самых быстро развивающихся. Но
при этом и степень изученности это области совсем далеко от полной.
Этим и хороша современная наука:
тем, что каждый день можно открывать для себя что-то новое.
Используемая
литература.
1)
Пороговая
активация св ртывания крови
и рост тромба в условиях кровотока (А.Л. Чуличков, А.В. Николаев, А.И. Лобанов,
Г.Т. Гурия)
2) Сравнение
двух математических моделей для описания пространственной динамики процесса
свертывания крови (А.И. Лобанов, Т.К. Старожилова, В.И. Зарницына, Ф.И. Атауллаханов)
3) Свёртывание крови: биохимические основы (М.А Пантелеев, Ф.И. Атауллаханов)
4) Свёртывание крови: методы исследования и механизмы регуляции (часть 2) (М.А
Пантелеев, Ф.И. Атауллаханов)
5)
Энциклопедия Общая
(теоретическая) биология
6)
Источник
фотографии - интернет