Применение нанотехнологий в биологии и медицине
V курс, IX семестр, специализация «Нанобиоматериалы и нанобиотехнологии»
Проф. Соболев А.С., проф. Максимов Г.В. (биологический факультет).
Аннотация
Дается анализ современных направлений нанобиотехнологии: биомедицинская диагностика; средства доставки лекарств; генотерапия; контроль состояния и жизнеобеспечения; нанокомпозитные материалы, а также методов микроскопии в исследовании клеток. Среди клеточных нанобиотехнологий обсуждаются этапы генетического программирования: культивирование опухолевых клеток пациентов вне организма; программирование гена и синтез иммуноактиваторного белка; введение модифицированных клеток больному; запуск собственного иммунитета, направленного против опухолевых клеток, а также стволовые клетки с генными конструкциями и нанотерапия и доставка лекарств (антитела; мультимодульные транспортеры; транспортные липосомы). Особое внимание уделялось методам атомно-силовой микроскопии, лазерной интерференционной микроскопии, конфокальной лазерной сканирующей флуоресцентной микроскопии и спектроскопии комбинационного рассеяния. Дается подробное описание принципа методов их преимуществ, сопоставлены различные типы микроскопов. Дается описание методик регистрации внутриклеточной структуры, а также формы эритроцитов и нервных клеток с помощью методов атомно-силовой микроскопии, лазерной интерференционной микроскопии и конфокальной микроскопии, а также спектроскопии комбинационного рассеяния. Делается вывод о возможности создания комплекса для измерения изменений субклеточных структур этих клеток и «наносом» (липосомы). В рамках клеточной нанобиотехнологии рассматриваются вопросы (на примере эритроцита): оценка вязкости плазматической мембраны эритроцита; оценка способности гемоглобина связывать и отдавать O2; оценка содержания комплексов гемоглобина с оксидом азота; оценка проницаемости плазматической мембраны эритроцита для ионов Ca, K, и H; оценка изменений формы и объема эритроцитов; оценка антиокислительного статуса крови.
Введение
В курсе лекций рассматриваются вопросы клеточной нанобиотехнологии и применения различных методов исследования этой проблемы. Различные микроскопические методы исследование уже в течение более 200 лет остаются одним из основных методов оценки формы и состояния клеток в норме и при различных воздействиях, включая различные наночастицы (НЧ). Как правило, биологические объекты — малые бесцветные полупрозрачные малоконтрастные объекты, поэтому для получения информации об их строении или функционировании которых приходится дополнительно увеличивать контраст биологических объектов, например, используя красители. Использование красителей позволяет улучшить разрешение изображения, однако, при этом может изменить физические свойства объекта (так использование флуоресцентных красителей стимулирует фотозависимое разрушение клеток), в результате окрашивание различными веществами не только повышает разрешение метода, но также оказывает дополнительное воздействие на функциональное состояние биологического объекта. Применение фазово-контрастных методов позволяет значительно повысить контраст биологического объекта, не прибегая к дополнительной модификации образца, что позволяет более корректно получать информацию о процессах, проходящих в клетках. Различные разновидности метода лазерной интерференционной микроскопии (ЛИМ) помимо увеличения контраста клеток, также позволяет количественно оценить изменение коэффициента преломления, толщины, а также количества вещества. Разновидность данной методики позволяет получить перераспределение данных характеристик в объеме клеток, получая, таким образом, пространственное трехмерное функциональное (отображающее распределение какой-либо характеристики) изображение объекта.
Фазово-контрастные методы обладают высокой точностью и позволяют оценить распределение веществ в клетке, обладающих различными показателями преломления. Однако у большинства белков значение показателя преломления мало различается и такими методами практически невозможно различить различные вещества, входящие в состав объекта. Это не имеет принципиального значения в случае объектов с однородным содержимым, например, красных клеток крови человека — эритроцитов, для которых легко и с высокой точностью можно оценить распределение и количество белка (гемоглобина), входящего в состав этой клетки. Однако в случае клеток имеющих неоднородное строение, к которым относится большинство живых объектов, трудно получить информацию о перераспределении различных белков (а также белков и ДНК), содержащихся в клетке.
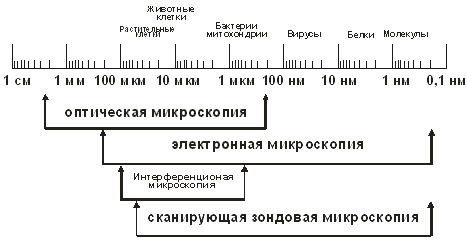
Размеры биологических объектов и возможности разрешения различных методов микроскопии.
Проблема может быть решена при использовании различных вариантов флуоресцентной (конфокальной) микроскопии. Используя данные разновидности микроскопии можно получать трехмерное пространственное распределение красителей внутри клетки, даже в очень низких концентрациях (до 1 молекулы). Размеры биологических объектов и возможности разрешения различных методов микроскопии.
Использование зондовой микроскопии также позволяет с высокой точностью получить функциональные изображения образцов. При этом по оси z (вертикальной оси) в каждой точке изображения будет отражена сила взаимодействия объекта с зондом. Регистрируя изменение спектра комбинационного рассеяния можно с высокой точностью и неинвазивно оценить изменения структуры молекулярных связей ряда веществ, что позволяет получать информацию об изменении в молекулярной структуре исследуемых вещества в точке, то есть на наноуровне организации структуры. Атомно-силовая микроскопия позволяет оценить геометрические размеры и толщину отдельных клеток, а также оценить состояние мембраны клетки. Помимо этого атомно-силовые (зондовые) микроскопы способны работать с маленькими (< 0,5 микрона) объектами, изображение которых практически невозможно получить при помощи оптических микроскопов.
Сочетание таких методов позволяет получить гораздо более подробную и точную картину состояния нативных (живых) биологических объектов in vitro и in vivo, кроме того, это значительно расширяет диапазон исследуемых объектов (см.рисунок), поскольку позволяет работать на макро-, микро- субмикро- и нано-уровне. Очевидно, что пространственно-временные изменения белков, их синтез и распад в процессе жизнедеятельности тканей и клеточных структур, а также воздействие на них внешней среды, реагентов и лекарств, должен быть выявлен и на наноуровне. Подобная задача становится особенно актуальной в связи с развитием нанобиотехнологии и ее медицинских приложений, в которых ключевую роль играют исследование различных функционирующих клеток и изучение действия на клетки наночастиц. Поскольку вследствие малого размера НЧ проходят через гематоэнцефалический барьер и могут накапливаться в клетках различных органов, то они способны влиять на разном уровне организации: макро- (многоклеточный организм в целом, ткани), микро- (клетки), субмикро- и нано- (клеточные органеллы и отдельные молекулы). Такая комплексная оценка требует наличия приборов, сочетающих в себе различные методы микроскопических исследований.
В качестве демонстрации возможности микроскопии в нанобиотехнологии были выбраны эритроциты, нейроны и нервные волокна и липосомы, а также их изменения с помощью «лазерного пинцета». Эритроциты — это безъядерные сравнительно просто устроенные клетки, которые являются одним из самых распространенных объектов нанобиотехнологических и биомедицинских исследований. Детальный анализ состояния эритроцитов необходим для тестирования лекарственных препаратов, в том числе НЧ, а также для диагностики патологических состояний организма. Нейроны — одни из наиболее сложноустроенных и высокоспецилизированных типов клеток, которые являются одним из наиболее сложных объектов исследования. Разработка методик неинвазивного исследования живых нервных клеток важна для решения как фундаментальных, так и прикладных нанобиотехнологических и медицинских задач.
В предлагаемом курсе лекций будет уделено внимание следующим вопросам применения микроскопии:
- Методики определения структурно-динамических изменений эритроцитов.
- Методика измерения структурно-динамических свойств цитоплазмы эритроцита с помощью интерференционной микроскопии.
- Методика регистрации и калибровки средств измерений топологии структур цитоплазмы эритроцита (ядерная и безъядерная форма).
- Методика определения структурно-динамических показателей функционального состояния нервной клетки.
- Методики определения результатов воздействия наночастиц на субклеточные структуры функционирующих клеток.
- Методика регистрации присутствия нанодисперсных металлических коллоидов (серебро и золото) в растворе и на поверхности клеток (эритроцит, нервная клетка).
- Методика регистрации топологии клеточных структур (эритроцит, нервная клетка) при действии наночастиц (металлические коллоиды серебра и золота).
- Методика применения «лазерного пинцета» и микроскопии.
В качестве одного из примеров клеточной нанобиотехнологии (на примере эритроцита) будут рассмотрены вопросы: оценки вязкости плазматической мембраны эритроцита; оценки способности гемоглобина связывать и отдавать O2; оценки содержания комплексов гемоглобина с оксидом азота; оценки проницаемости плазматической мембраны эритроцита для ионов Ca, K, и H; оценки изменений формы и объема эритроцитов. В лекциях будет рассмотрено строение гемоглобина и его исследование с помощью спектроскопии комбинационного рассеяния (исследование изменений конформации гемопорфирина гемоглобина), а также антиоксидантная система плазмы крови. Супероксиддисмутаза. Дисмутация О2*- супероксиддисмутазой. Деактивация перекиси водорода. Акцепторы радикалов: аскорбиновая кислота (витамин С), сульфгидрильные соединения (глутатион, цистеин), одно- и многоатомные спирты (этанол, рибоза, глюкоза и др.) Особое внимание уделяется спектроскопии гигантского комбинационного рассеяния и ее особенностям: спектр ГКР ≠ усиленный спектр КР: спектры ГКР практически никогда не являются точной копией спектров КР; усиление в низкочастотной области больше, чем в высокочастотной; усиление полосы в спектре ГКР зависит от ориентации связей молекулы по отношению к НЧ, т.е. как молекула/клетка сорбировались на НЧ; при взаимодействии с НЧ изменяется симметрия молекулы и в спектре ГКР появляются асимметричные колебания (для центрально-симметричных молекул).
Список лекций курса
Лекция 1.
1.1. Модуляция оптического излучения живыми микрообъектами
1.1.1 Свет и его характеристики
1.2 Прохождение света через клетку
1.3 Физическая модель клетки
1.4 Взаимодействие света с живой клеткой
1.5 Что мы видим при наблюдении видеоизображения живой клетки
1.6 Уравнения распространения излучения в среде
1.6.1 Теория однократного рассеяния
1.7 Метод геометрической оптики
1.8 Поглощающие объекты
1.9 Флуоресцирующие объекты
1.10 Двулучепреломляющие объекты
Лекция 2.
2.1 Микроскоп. Устройство и современные задачи
2.1.1 Микроскоп. Устройство и современные задачи
2.1.2 Оптическая схема микроскопа
2.1.2.1 Принцип действия микроскопа
2.1.2.2 Оценка качества изображений в микроскопии
2.2 Методы микроскопии биообъектов
2.2.1 Метод светлого поля
2.2.2 Метод темного поля
2.2.3 Метод фазового контраста
2.2.4 Интерференционный контраст
2.2.5 Ширинг системы. Дифференциальные интерференционные микроскопы
2.2.6 Поляризационная микроскопия
2.2.7 Флуоресцентная (люминесцентная) микроскопия
2.3 Особенности современных микроскопов
2.3.1 Системы автоматизированной обработки изображений микрообъектов
2.4 Измерение оптической плотности клетки (денситометрия)
2.5 Измерение цветовых характеристик изображений микрообъектов (колориметрия)
2.6 Измерение геометрических размеров клеток ( морфометрия)
2.7 Подсчет количества клеток и распределения клеток по размерам
Лекция 3.
3.1 Микроинтерферометрия
3.1.1 Схемы оптических микроинтерферометров
3.2 Микроинтерферометр Линника
3.2.1 Формирование интерференционного изображения в микроскопе Линника с широким источником пространственно-некогерентного света
3.3.2 Исследование контраста и области локализации интерференционной картины в микроскопе Линника
3.3.4 Реконструкция ОРХ (оптической разности хода)
Лекция 4.
4.1 Конфокальный микроскоп
4.2 Цифровая голографическая микроскопия
4.3 Микротомография биообъектов
4.3.1 Микротомограф на основе интерференционного микроскопа Линника
4.3.2 Современные томографические системы
Лекция 5. Атомно-силовая микроскопия
Лекция 6.
6.1.Микроскопия с помощью спектроскопии комбинационного рассеяния
6.2. Микроскопия высокого разрешения (спектроскопия гигантского комбинационного рассеяния Surface Enhanced Raman Spectroscopy)
Лекция 7. Спектроскопия комбинационного рассеяния: определение конформацие гемопорфирина и содержания Hb-O2 и комплексов Hb-NO
Лекция 8. Применение современной микроскопии и «оптического пинцета». Методы клеточной хирургии
Вопросы к циклу лекций
- Принцип и свойства лазерной интерференционной микроскопии.
- Метод конфокальной сканирующей микроскопии.
- Метод сканирующей зондовой микроскопии.
- Спектроскопия комбинационного рассеяния.
- Регистрация состояния клеток с помощью атомно-силовой сканирующей микроскопии.
- Методики определения структурно-динамических изменений эритроцитов.
- Методика измерения структурно-динамических свойств цитоплазмы эритроцита с помощью интерференционной микроскопии.
- Методика регистрации и калибровки средств измерений топологии структур цитоплазмы эритроцита (ядерная и безъядерная форма).
- Методика определения структурно-динамических показателей функционального состояния нервной клетки.
- Методики определения результатов воздействия наночастиц на субклеточные структуры функционирующих клеток.
- Методика регистрации присутствия нанодисперсных металлических коллоидов (серебро и золото) в растворе и на поверхности клеток (эритроцит, нервная клетка).
- Методика регистрации топологии клеточных структур (эритроцит, нервная клетка) при действии наночастиц (металлические коллоиды серебра и золота).
- Применение спектроскопии комбинационного рассеяния для оценки состояния наноструктур (липосом).
- Применение спектроскопии гигантского комбинационного рассеяния для оценки конформации и распределения гемоглобина.
- Применение конфокальной микроскопии для оценки функционирования субклеточных наноструктур ( на примере нейрона).
- Как с помощью ЭПР спектроскопии можно исследовать упорядоченность (вязкость) гидрофильного и гидрофобного компартмента биологической мембраны?
- Как меняется вязкость липидного бислоя мембраны эритроцита больных различной сердечно-сосудистой этиологии.
- Как меняется активность Na+/H+-обмена, Ca2+-ATPазы и Са-зависимых К-каналов эритроцитов при сердечно-сосудистой патологии?
- Какие свойства гемоглобина регулируются за счет разнообразных эндо- и экзогенных молекул и при каких условиях.
- Какие свойства гемоглобина меняются при переходе из свободного цитоплазматического состояния в состояние, связанное на мембране.
- Какие мембранные процессы могут оказывать существенное влияние на примембранный гемоглобин и эритроцит в целом.
- Какие свойства гемоглобина и эритроцитов изменяются при патологиях в сердечно-сосудистой и нервной системах.
- Методы клеточной хирургии. Применение современной микроскопии и «оптического пинцета».
Рекомендуемая литература:
- Hematologic Pathophysiology. Lippincott-Raven, Philadelphia.1998.
- Гилсон, Т. и П. Хендра. 1973. Лазерная спектроскопия КР в химии. МИР, Москва.
- Andreev V.A. и Indukaev K.V. The problem of subrayleigh resolution in interference microscopy. J. Russ. Laser Res. 2003. 24. 220-236.
- Andreev, V., K. Indukaev, O. Ioselev, A. Legkii, G. Lazarev, D. Orlov. Phase Modulation Microscope MIM-2.1 for Measurements of Surface Microrelief. Results of Measurements. J. Russ. Laser Res. 2005. 26. 394-401.
- Barer, R. и S. Joseph. Refractometry of Living Cells. Part I. Basic Principles. Quarterly Journal of Microscopical Science. 1954. 95. 399-423.
- Bennet, A.H., H. Jupnik, H. OIsterberg, O.W. Richards. 1951. Phase microscopy. Principles and Applications. New York, London.
- Bessis, M. Red cell shapes. An illustrated classification and its rationale. Nouv. Rev. Fr. Hematol. 1972. 12. 721-745.
- Bessis, M. 1974. Corpuscles: Atlas of red blood cell shape.
- Brazhe, N.A., A.R. Brazhe, O.V. Sosnovtseva, A.N. Pavlov, L.A. Erokhova, A.I. Yusipovich, G.V. Maksimov, E. Mosekilde. Unraveling cell processes: interference imaging weaved with data analysis. Journal of Biological Physics. 2006. 32. 191-208.
- Brazhe, N.A., Erokhova L.A., Churin A.A., Maksimov G.V. The relation of different-scale membrane processes under nitric oxide influence. Journal of Biological Physics. 2005. 31. 533-546.
- Chong, C.S. и K. Colbow. Light scattering and turbidity measurements on lipid vesicles. Biochim. Biophys. Acta. 1976. 436. 260-282.
- Curl, C.L., C.J. Bellair, P.J. Harris, B.E. Allman, A. Roberts, K.A. Nugent, L.M. Delbridge. Single cell volume measurement by quantitative phase microscopy (QPM): a case study of erythrocyte morphology. Cell Physiol Biochem. 2006. 17. 193-200.
- Dunn, G.A. и D. Zicha. Dynamics of fibroblast spreading. J Cell Sci. 1995. 108 ( Pt 3). 1239-1249.
- Erokhova, L.A., N.A. Brazhe, G.V. Maksimov, A.B. Rubin. Analysis of conformational changes in neuronal carotenoids under the influence of neuromediator. Dokl. Biochem. Biophys. 2005a. 402. 233-235.
- Erokhova, L.A., S.M. Novikov, G.L. Lazarev, T.A. Kazakova, D.A.Orlov, K.V.Indukaev, G.V.Maksimov. Study of Regular Intracellular and membrane Processes in Neurons by Laser Interference Microscopy. Bull. Exp. Biol. Med. 2005b. 140. 262-264.
- Gan, W.B., E. Kwon, G. Feng, J.R. Sanes, J.W. Lichtman. Synaptic dynamism measured over minutes to months: age-dependent decline in an autonomic ganglion. Nat. Neurosci. 2003. 6. 956-960.
- Gedde, M.M., E. Yang, W.H.Huestis. Shape response of human erythrocytes to altered cell pH. Blood. 1995. 86. 1595-1599.
- Gifford, S.C., M.G. Frank, J. Derganc, C. Gabel, R.H. Austin, T. Yoshida, M.W. Bitensky. Parallel microchannel-based measurements of individual erythrocyte areas and volumes. Biophys. J. 2003. 84. 623-633.
- Hobbs, A.J., M.T. Gladwin, R.P. Patel, D.L. Williams, A.R. Butler. Haemoglobin: NO transporter, NO inactivator or NOne of the above? Trends Pharmacol. Sci. 2002. 23. 406-411.
- Максимов, Г.В., Н. Раденович, Ю.Е. Борисова, М.К. Еремич. Исследование вязкости возбудимых мембран с помощью спектроскопии комбинационного рассеяния. Биофизика. 1996. 41. 400-406.
- Петруняка, В.В. Выделение каротиноидсодержащих субклеточных структур из нервной ткани моллюска. Цитология. 1976. 18. 1185.
- Jonson, R.M., G. Taylor, D.B. Meyer. Shape and Volume Changes in Erythrocyte Ghosts and Spectrin-Actin Networks. The Journal of cell biology. 1980. 86. 371-376.
- Kemper,B.и von Bally, G.. Digital holographic microscopy for live cell applications and technical inspection. Appl. Opt. 2008. 47. A52-A61.
- Kugeiko, M. и S. Lysenko. Human erythrocyte refractive index determination from nephelometric optical characteristics. Measurement Techniques. 2007. 50. 1326-1332.
- Leake, L.D., M.P. Davis, D. Chen, L.L. Moroz. An unique model for the analysis of neuronal nitric oxide signaling: the leech CNS. Acta Biol. Hung. 1995. 46. 135-143.
- Levin, G.G., Bulygin Th.V., Vishnyakov G.N. Coherent Oscillations Of The Molecular State Of Protein In Live Cells. Tsitologiya. 2005. 47. 348-356.
- Levin, G.G. Contemporary methods of optical tomography and holography. Measurement Techniques. 2005a. 48. 1103-1108.
- Levin, G.G., Th.V. Bulygin, G.N. Vishnyakov. Coherent Oscillations Of The Molecular State Of Protein In Live Cells. Tsitologiya. 2005b. 47. 348-356.
- Lew, V.L., J.E. Raftos, M. Sorette, R.M.Bookchin, N.Mohandas. Generation of normal human red cell volume, hemoglobin content, and membrane area distributions by "birth" or regulation? Blood. 1995. 86. 334-341.
- Maksimov, F.B. и S.N. Orlov. [The effect of human and rat erythrocyte volume on the structure of hemoglobin protoporphyrin]. Biofizika. 1993. 38. 804-808.
- Maksimov, G.V., A.A. Churin, V.Z. Paschenko, A.B. Rubin. Raman spectroscopy of the "potential sensor" of potential-dependent channels. Gen. Physiol Biophys. 1990. 9. 353-360.
- Maksimov, G.V., S.L.Nikandrov, E.S.Lazareva, V.P.Tychinskii. [Registration by dynamic phase microscopy of characteristic frequencies of phase height fluctuations of the myelin nerve fiber at rest and under stimulation]. Biofizika. 2002. 47. 345-351.
- Maksimov, G.V., S.L. Nikandrov, E.S. Lazareva, V.P. Tychinskii, A.B. Rubin. A study of demyelination of nerve fibers using dynamic phase contrast microscopy. Bull. Exp. Biol. Med. 2001. 131. 457-460.
- Mazeron, P., J. Didelon, S. Muller, J.F. Stoltz. A theoretical approach of the measurement of osmotic fragility of erythrocytes by optical transmission. Photochem. Photobiol. 2000. 72. 172-178.
- Соловьев, К.Н., Л.Л. Гладков, А.С. Старухин, С.Ф. Шкирман. 1985. Спектроскопия порфиринов: Колебательные состояния. Наука и техника, Минск.
- Petran, M., M. Hadravsky, J. Benes, A. Boyde. In vivo microscopy using the tandem scanning microscope. Ann. N. Y. Acad. Sci. 1986. 483. 440-447.
- Popescu, G., K. Badizadegan, R.R. Dasari, M.S. Feld. Observation of dynamic subdomains in red blood cells. J Biomed. Opt. 2006. 11. 040503.
- Popescu, G., T. Ikeda, C.A. Best, K. Badizadegan, R.R. Dasari, M.S. Feld. Erythrocyte structure and dynamics quantified by Hilbert phase microscopy. J Biomed. Opt. 2005. 10. 060503.
- Racker, E. A new procedure for the reconstitution of biologically active phospholipid vesicles. Biochem. Biophys. Res. Commun. 1973. 55. 224-230.
- Rappaz, B., A. Barbul, F. Charriere, J. Kuhn, P. Marquet, R.Korenstein, C.Depeursinge, P.Magistretti. Erythrocytes volume and refractive index measurement with a digital holographic microscope. SPIE--The International Society for Optical Engineering. 2007. 6445. 644509.
- Rappaz, B., F. Charriere, C. Depeursinge, P.J. Magistretti, P. Marquet. Simultaneous cell morphometry and refractive index measurement with dual-wavelength digital holographic microscopy and dye-enhanced dispersion of perfusion medium. Opt. Lett. 2008. 33. 744-746.
- Rappaz, B., P. Marquet, E. Cuche, Y. Emery, C. Depeursinge, P. Magistretti. Measurement of the integral refractive index and dynamic cell morphometry of living cells with digital holographic microscopy. Opt. Express. 2005. 13. 9361-9373.
- Rasia, M. и A.Bollini. Red blood cell shape as a function of medium's ionic strength and pH. Biochim. Biophys. Acta. 1998. 1372. 198-204.
- Sosnovtseva, O.V., A.N. Pavlov, N.A. Brazhe, A.R. Brazhe, L.A. Erokhova, G.V. Maksimov, E. Mosekilde. Interference microscopy under double-wavelet analysis: a new approach to studying cell dynamics. Phys. Rev. Lett. 2005. 94. 218103.
- Tang, S. Generalized algorithm for phase shifting interferometry. Proc. SPIE. 1996. 2860. 34-44.
- Tominaga, T., S. Sato, T. Ohnishi, S.T. Ohnishi. Potentiation of nitric oxide formation following bilateral carotid occlusion and focal cerebral ischemia in the rat: in vivo detection of the nitric oxide radical by electron paramagnetic resonance spin trapping. Brain Res. 1993. 614. 342-346.
- Tychinskii, V.P., D. Weiss, T.V. Vyshenskaia, L.S. Iaguzhinskii, Nikandrov S.L. [Cooperative processes in mitochondria: registration by dyanmic phase microscopy]. Biofizika. 2000. 45. 870-877.
- Tychinsky, V., A. Kretushev, T. Vyshenskaja. Mitochondria optical parameters are dependent on their energy state: a new electrooptical effect? Eur. Biophys. J. 2004a. 33. 700-705.
- Tychinsky, V.P., A.V. Kretushev, T.V. Vyshenskaya, A.N. Tikhonov. A dynamic phase microscopic study of optical characteristics of individual chloroplasts. Biochim. Biophys. Acta. 2004b. 1665. 57-64.
- Tychinsky, V.P., A.V. Kretushev, T.V.Vyshenskaya, A.N.Tikhonov. Coherent phase microscopy in cell biology: visualization of metabolic states. Biochim. Biophys. Acta. 2005. 1708. 362-366.
- Ukhanov, A.A. и V.P. Tychinskii. [Quantitative characteristics of polarization images]. Med. Tekh. 1996. 4. 9-13.
- Van Asseldelft, O.W. 1970. Spectrophotometry of haemoglobin derivatives. Assen.
- Vishnyakov и G.G. Levin. Linnik tomographic microscope for investigation of optically transparent objects. Measurement Techniques. 1998. 41. 906-911.
- Wilson, T. and C.J.R. Sheppard. 1985. Theory and Practice of Scanning Optical Microscopy. Academic Press.
- Wong, P. The behavior of the human erythrocyte as an imperfect osmometer: a hypothesis. J Theor. Biol. 2006. 238. 167-171.
- Yusipovich, A.I., S.M. Novikov, T.A. Kazakova, L.A. Erokhova, N.A. Brazhe, G.L. Lazarev, G.V. Maksimov. Peculiarities of studying an isolated neuron by the method of laser interference microscopy. QUANTUM ELECTRON. 2006. 36. 874-878.
